
Thu hồi khẩn cấp 11 thuốc chứa tạp chất N-nitrosodimethylamine gây ung thư
Viện Kiểm nghiệm thuốc Trung ương, Viện Kiểm nghiệm thuốc TP HCM hướng dẫn các Trung tâm kiểm nghiệm thực hiện quy trình phân tích xác định tạp chất NDMA trong thuốc chứa dược chất ranitidine.
Cục Quản lý Dược, Bộ Y tế vừa có công văn số 16813/QLD-CL và 16814/QLD-CL thông báo việc thu hồi thuốc chứa ranitidine có chứa tạp chất tạp chất N-nitrosodimethylamine (NDMA) vượt giới hạn cho phép. Đây là thành phần chính trong các thuốc điều trị viêm loét dạ dày và ruột, tuy nhiên, do hàm lượng tạp chất NDMA vượt mức cho phép nên có khả năng gây ung thư.
Căn cứ vào các quy chế dược hiện hành của Việt Nam; thông báo của Cơ quan Khoa học y tế Singapore (HSA); các cơ quan quản lý dược phẩm các nước: Thụy Sĩ (Swissmedic), châu Âu (EMA), Hoa Kỳ (US-FDA) về việc phát hiện các thuốc chứa ranitidine có tạp chất N-nitrosodimethylamine có hàm lượng vượt quá ngưỡng cho phép của quốc tế, làm tăng nguy cơ gây ung thư.
Phần lớn các thuốc bị thu hồi lần này đều có xuất xứ từ Anh, Ý, Ấn Độ, Malaysia, Tây Ban Nha và Thái Lan.
Để đảm bảo an toàn cho người sử dụng, Cục Quản lý Dược yêu cầu thu hồi tất cả các thuốc thành phẩm có tên sau đây:
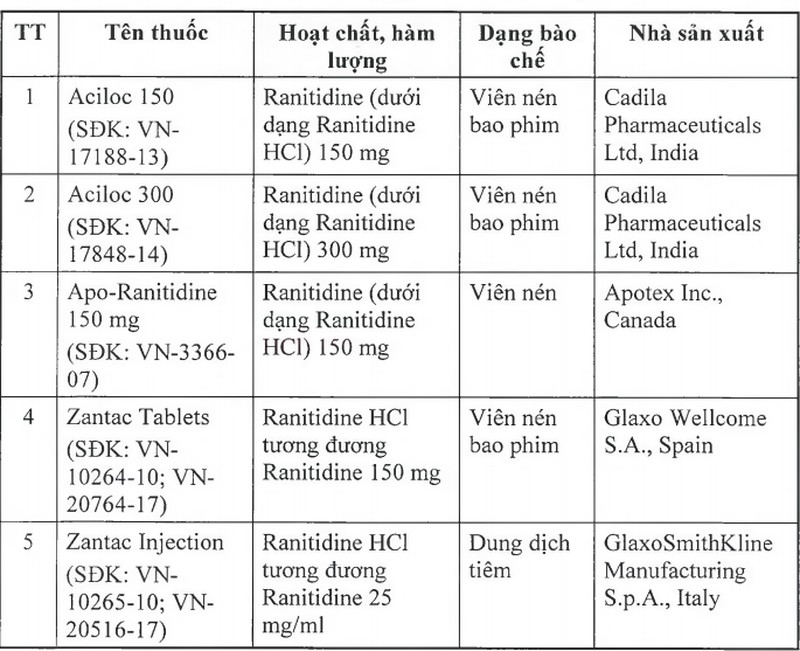
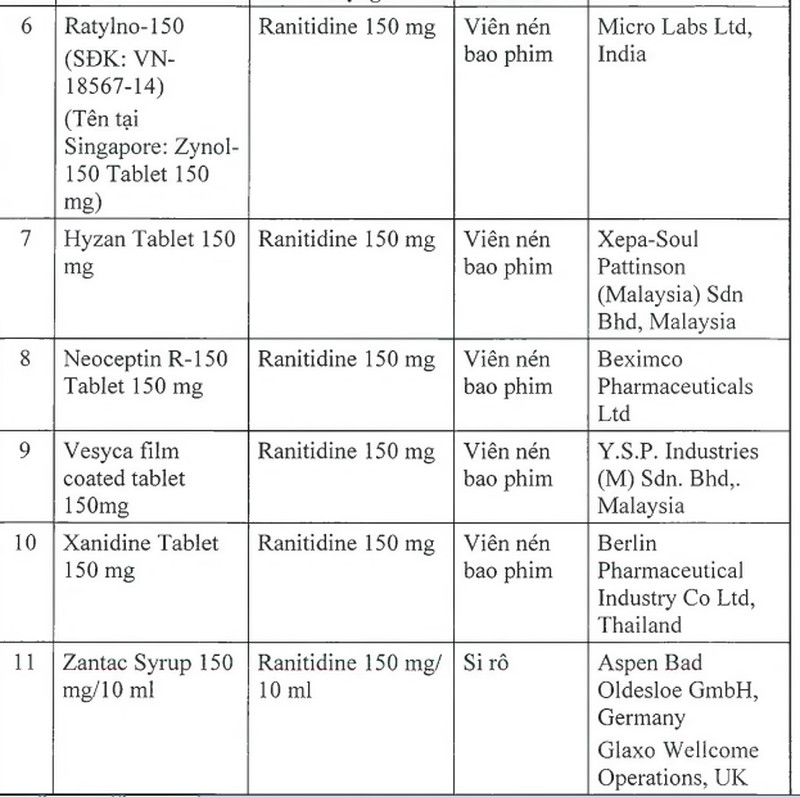
Cục Quản lý Dược yêu cầu các Công ty nhập khẩu thuốc phối hợp với nhà phân phối thuốc thông báo thu hồi tất cả các lô thuốc thành phấm nêu trên tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc và tiến hành thu hồi toàn bộ các lô thuốc này; gửi báo cáo thu hồi về Cục Quản lý Dược trong vòng 01 tháng.
Cục cũng đề nghị Sở Y tế các tỉnh, thành phố thông báo việc thu hồi tới các cơ sở kinh doanh, sử dụng thuốc trên địa bàn; Công bố thông tin việc thu hồi tất cả các thuốc thành phẩm nêu trên trên Trang thông tin điện tử của Sở; Kiểm tra và giám sát các Công ty nhập khẩu thuốc trên địa bàn thực hiện việc thu hồi các thuốc nêu trên.
Ngoài ra để đảm bảo chất lượng thuốc, Cục Quản lý Dược yêu cầu các cơ sở sản xuất thuốc chứa dược chất ranitidine chỉ được đưa vào sản xuất thuốc các lô nguyên liệu dược chất ranitidine không có tạp chất NDMA. Trường hợp lô nguyên liệu dược chất ranitidine có tạp chất NDMA thì không được vượt quá giới hạn cho phép của tạp chất NDMA theo giới hạn chấp nhận quy định tại ICH M7.
Cục cũng yêu cầu các cơ sở sản xuất thuốc thực hiện đánh giá và kiểm soát chặt chẽ cơ sở cung ứng nguyên liệu, nguồn gốc nguyên liệu; Kiểm tra chất lượng từng lô nguyên liệu dược chất ranitidine theo quy định và phân tích bổ sung chỉ tiêu đối với tạp chất NDMA.

Zantac là loại thuốc phổ biến giúp giảm axit trong dạ dày và ngăn ợ nóng
Yêu cầu các cơ sở nhập khẩu thuốc, nguyên liệu dược chất ranitidine: Thực hiện nghiêm túc việc đánh giá cơ sở cung cấp, cơ sở sản xuất nguyên liệu, cơ sở sản xuất thuốc thành phẩm; Cơ sở nhập khẩu nguyên liệu chỉ nhập khẩu các lô nguyên liệu ranitidine đạt tiêu chuẩn chất lượng theo tiêu chuẩn đã được chấp nhận, đồng thời không có hoặc không vượt quá giới hạn cho phép các tạp chất NDMA.
Cục Quản lý Dược đề nghị Viện Kiểm nghiệm thuốc Trung ương, Viện Kiểm nghiệm thuốc TP HCM:
Nghiên cứu, triến khai và hướng dẫn các Trung tâm kiểm nghiệm tỉnh, thành phố thực hiện quy trình phân tích xác định tạp chất NDMA trong nguyên liệu và trong thuốc chứa dược chất ranitidine; Tăng cường lấy mẫu để kiểm tra chất lượng nguyên liệu và thuốc chứa dược chất ranitidine tại cơ sở nhập khẩu và cơ sở sản xuất thuốc, và ưu tiên phân tích bổ sung xác định tạp chất NDMA trong mẫu đã lấy.
Vũ Hải
Nguồn: vietq.vn/ kienthuc.net.vn/


Phát biểu của Tổng Bí thư Tô Lâm tại Lễ kỷ niệm 80 năm Ngày Tổng tuyển cử đầu tiên bầu Quốc hội Việt Nam

Lễ kỷ niệm 80 năm Ngày Tổng tuyển cử đầu tiên bầu Quốc hội Việt Nam

Bộ Khoa học và Công nghệ giữ vai trò dẫn dắt tri thức số quốc gia

Đại hội nhiệm kỳ V - Hội các Phòng thử nghiệm Việt Nam nhiệm kỳ 2025-2030: Tiếp tục khẳng định vai trò nòng cốt của ngành thử nghiệm trong hệ thống chất lượng quốc gia

Chống hàng giả và bảo vệ người tiêu dùng trong thương mại điện tử: Yêu cầu cấp thiết về minh bạch, trách nhiệm và công cụ quản lý số
Đại hội Đại biểu toàn quốc lần thứ V Hội các Phòng thử nghiệm Việt Nam, Nhiệm kỳ 2025–2030 sẽ diễn ra vào ngày 20/12
Vai trò của báo chí trong việc xây dựng và phát triển Liên hiệp các Hội Khoa học và Kỹ thuật Việt Nam
Tọa đàm trực tuyến: ‘Năng suất chất lượng và hành trình Net Zero của doanh nghiệp Việt’

Sẵn sàng triển khai Sổ tay đảng viên điện tử đồng bộ trên toàn Đảng

Việt Nam, Hoa Kỳ công bố Tuyên bố chung về Khuôn khổ Hiệp định Thương mại đối ứng













