
Công nghệ sinh học thực vật và tiềm năng trong đối phó với SARS-CoV-2
TNNN – Công nghệ sinh học thực vật đã và đang góp phần quan trọng vào công cuộc chống lại đại dịch COVID-19.
- Phát triển công nghệ mới giúp theo dõi miễn dịch vắc xin COVID-19
- Các nhà nghiên cứu khám phá cách thức thuốc trừ sâu sinh học chống nhện ve
- Phát triển công nghệ mới giúp theo dõi miễn dịch vắc xin COVID-19
Các quốc gia trên thế giới đang nỗ lực phát triển những sản phẩm thuốc thử chẩn đoán, vaccine và thuốc kháng virus nhằm bảo vệ tính mạng con người cũng như làm chậm sự lây lan của đại dịch COVID-19 gây ra bởi virus SARS-CoV-2. Một phần của nỗ lực quốc tế đó được tập trung trên đối tượng thực vật, các nghiên cứu này đã góp phần cung cấp kháng nguyên protein, kháng thể cho sản phẩm kít chẩn đoán cũng như hệ thống sản xuất, từ đó có thể mở rộng quy mô để cung ứng khẩn cấp vắc xin và thuốc kháng virus. Điều này cho thấy tiềm năng rất lớn của công nghệ sinh học thực vật trong đối phó với đại dịch COVID-19.
Công nghệ sinh học thực vật có thể giúp ích như thế nào trong cuộc chiến chống COVID-19?
Tốc độ lây lan nhanh chóng của COVID-19 trên toàn cầu đã thúc đẩy các nước phải tiến hành hàng loạt biện pháp khẩn cấp và liên hoàn để làm chậm mức độ bùng phát của virus trong cộng đồng, từ đó giảm áp lực lên hệ thống y tế quốc gia. Thách thức lớn của COVID-19 là yêu cầu xét nghiệm đại trà cho số lượng lớn người dân, đây là khó khăn chưa từng có.
Bên cạnh đó, các biện pháp kiểm soát giúp có thêm thời gian để phát triển kít chẩn đoán bệnh, phương pháp điều trị, cũng như tạo ra những sản phẩm vaccine tiềm năng để bảo vệ bộ phận dân số chưa bị nhiễm virus.
Thực tế cho thấy, nghiên cứu sản xuất trên thực vật có thể tiết kiệm chi phí hơn rất nhiều so với trên hệ thống tế bào động vật có vú truyền thống (1/30 kinh phí đầu tư) hoặc trên hệ thống nuôi cấy vi sinh vật (1/3 kinh phí đầu tư).
Cụ thể, biểu hiện tạm thời trên một số đối tượng cây trồng (thuốc lá, cây họ đậu và ngũ cốc) được đánh giá là một nền tảng rất có tiềm năng để tạo ra các protein chẩn đoán, sản phẩm vaccine và protein kháng virus SARS-CoV-2 do phương pháp này không yêu cầu tạo ra dòng tế bào ổn định để sản xuất sản phẩm cuối cùng, giúp cung cấp vật liệu cho thử nghiệm lâm sàng trong vòng vài tuần trở nên khả thi với mức đầu tư tối thiểu.
Vaccine có nguồn gốc thực vật đóng vai trò không thể thiếu trong cuộc chạy đua này do thời gian tạo ra vaccine (kể từ khi xác định trình tự của chủng virus gây bệnh) ngắn hơn so với vaccine làm từ trứng hoặc trên tế bào động vật có vú truyền thống [1]. Bên cạnh đó, nghiên cứu trên thực vật cũng cho thấy tiềm năng to lớn trong việc sản xuất thuốc thử chẩn đoán SARS-CoV-2 và thuốc kháng virus (hình 1).
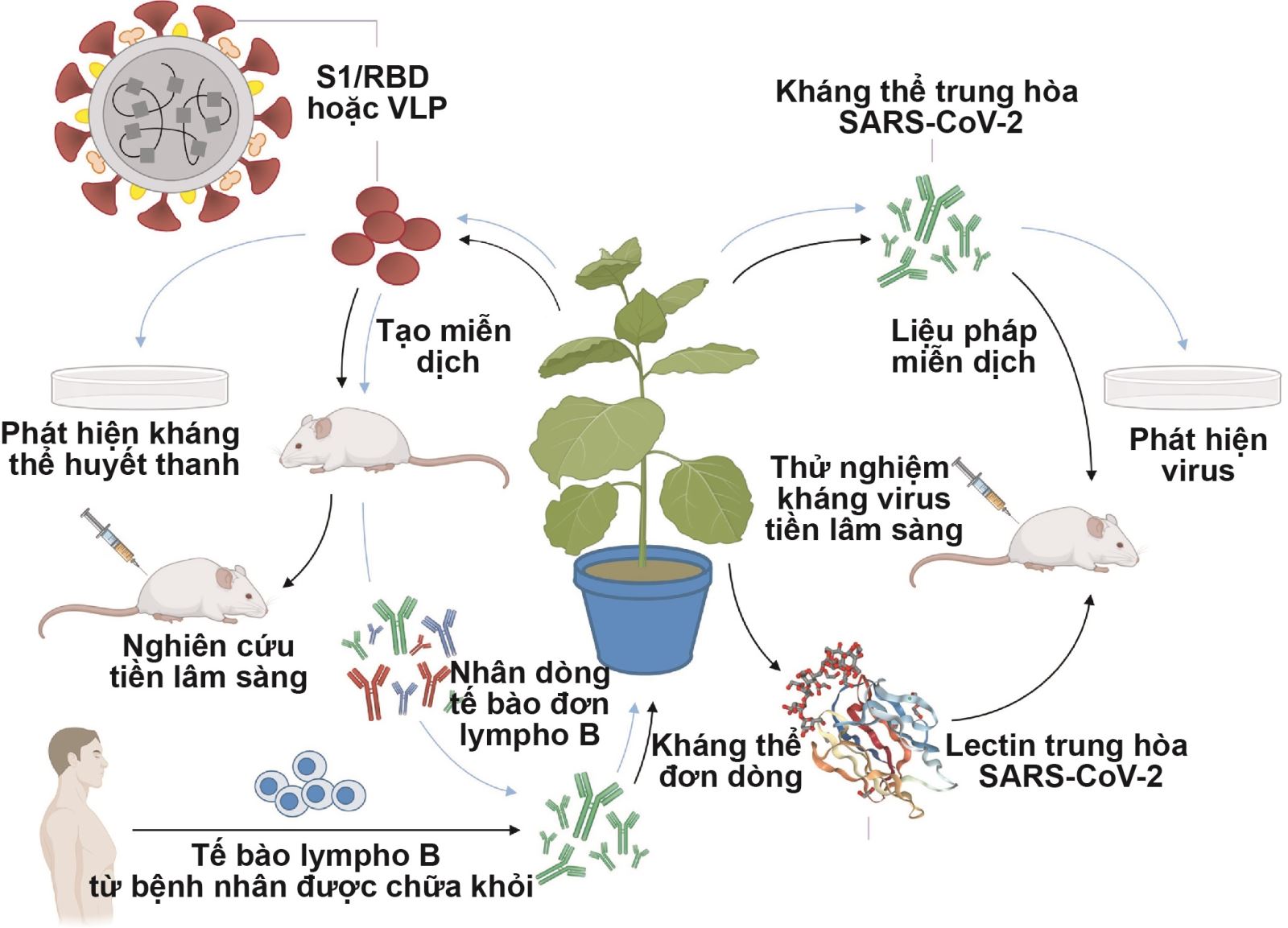
Hình 1. Vai trò của thực vật trong sản xuất thuốc thử phát hiện, vaccine và protein chống virus để đối phó với đại dịch COVID-19.
Sử dụng thực vật trong sản xuất thuốc thử phát hiện SARS-Cov-2
Trong hơn 30 năm qua, thực vật đã được sử dụng thông dụng trong sản xuất thuốc thử phát hiện bệnh và protein tái tổ hợp dược phẩm [2]. Ví dụ, globulin miễn dịch A/G (IgA/G) khảm tạo ra từ lá của cây thuốc lá chuyển gen đã được Công ty Planet Biotechnology (Hoa Kỳ) đưa ra thị trường với sản phẩm CaroRX dùng trong điều trị vi khuẩn gây sâu răng [3].
Enzyme glucocerbrosidase tái tổ hợp được tạo ra trong nuôi cấy huyền phù tế bào thực vật đã được phát triển thành sản phẩm Elelyso và sử dụng như một liệu pháp điều trị cho bệnh nhân Gaucher tuýp 1 (một dạng bệnh rối loạn di truyền hiếm gặp) [3].
Đến nay, sự lây lan nhanh chóng của COVID-19 đã tạo ra nhu cầu lớn và đột ngột về các kít chẩn đoán. Hai hướng xét nghiệm chẩn đoán chính được tập trung, đó là phát hiện virus (xác định người bị nhiễm trong cộng đồng) và phát hiện kháng thể chống lại virus. Trong đó, xét nghiệm chẩn đoán COVID-19 được tiến hành dựa trên việc phát hiện: (i) RNA hoặc (ii) protein của virus SARS-CoV-2.
Trình tự của virus SARS-CoV-2 công bố trên ngân hàng gen NCBI (Accession number: NC_045512.2) đã cho phép các nhà khoa học có thể thiết kế các đoạn mồi đặc trưng nhằm nhân các đoạn gen đặc trưng thông qua phương pháp RT-qPCR [4]. Tuy nhiên, một vấn đề đặt ra là xét nghiệm này thiếu đối chứng dương phổ rộng cho phép chuẩn hóa giữa nhiều phòng thí nghiệm khác nhau.
Gần đây, một thuốc thử đối chứng dùng trong phát hiện COVID-19 đã được phát triển bởi Trung tâm John Innes (Anh) dựa trên các hạt tương tự virus (virus-like particle - VLP) có kích thước ∼30nm, nguồn gốc từ virus khảm đậu đũa (cowpea mosaic virus - CPMV) [5].
Cụ thể, một dạng RNA nhân tạo mang tất cả vùng genome của virus SARS-CoV-2 (phát hiện bởi kít xét nghiệm của Tổ chức Y tế thế giới) được đưa vào VLP có nguồn gốc CPMV, sau đó các dạng hạt này được tổng hợp trên thực vật [6]. VLP là một dạng thuốc thử có tính bền nhiệt, dễ sản xuất, có khả năng mở rộng quy mô và có thể được sử dụng làm nguồn RNA đối chứng dương trong các xét nghiệm RT-qPCR [6].
Kỹ thuật tạo các dạng VLP từ thực vật để làm mẫu đối chứng dương trong xét nghiệm bệnh đã rất phổ biến, như dùng vỏ capsid của CPMV để bọc RNA mục tiêu của coxsackievirus A16 và enterovirus 71 trong phát hiện bệnh tay chân miệng, sử dụng virus khảm thuốc lá (tobacco mosaic virus) để phát triển làm đối chứng dương trong phát hiện Ebola, sử dụng bacteriophage Qβ để làm đối chứng chẩn đoán virus gây ngộ độc thực phẩm [5].
Việc phát triển các kít chẩn đoán nhanh COVID-19 dựa trên phát hiện kháng nguyên (protein đặc hiệu của virus SARS-CoV-2) đòi hỏi phải xác định các kháng thể tương ứng [4].
Cụ thể, hạt SARS-CoV-2 trưởng thành có chứa 4 protein cấu trúc, bao gồm vỏ E (envelope, mã định danh protein: YP_009724392), màng M (membrane, mã định danh protein: YP_009724393), vỏ bọc nhân N (nucleocapsid, mã định danh protein: YP_009724397), và gai S (spike, mã định danh protein: YP_009724390) [7]. Trong đó, gai S là protein quan trọng nhất trong phát hiện kháng nguyên vì nó nhô ra từ bề mặt của hạt virus và làm lộ vùng liên kết thụ thể (receptor-binding domain - RBD) [6].
Việc tiêm virus SARS-CoV-2 hoặc gai/RBD vào chuột có thể tạo ra các dòng tế bào u sinh kháng thể (hybridoma) sản sinh ra nhiều bản sao của cùng một kháng thể. Protein gai/RBD cũng có thể được sử dụng để sàng lọc các dòng có kháng thể kháng virus, tạo ra các kháng thể có ái lực cao với protein gai của SARS-CoV-2, từ đó phát triển thành kít ELISA và sắc ký miễn dịch [6, 8]. Đối với các protein tái tổ hợp của SARS-CoV-2, biểu hiện kháng thể tạm thời ở thực vật chuyển gen giúp rút ngắn thời gian sản xuất và đáp ứng nguồn cung ứng lớn trong dài hạn [8].
Cụ thể, đoạn mã hóa vùng RBD nằm trên gai của SARS-CoV-2 và kháng thể đơn dòng chống COVID-19 (mAb, anti-SARS-CoV monoclonal antibody) CR3022 được biểu hiện tạm thời trên cây thuốc lá bằng chủng Agrobacterium tumefaciens GV3101 [8].
Sau 10 ngày kể từ khi tách dòng, đoạn RBD của SARS-CoV-2 và mAb CR3022 đã tạo ra RBD và mAb CR3022 từ cây thuốc lá với hiệu suất 8 và 130 μg/g lá tươi, trong đó RBD thực vật thể hiện tính bám đặc hiệu với thụ thể của virus SARS-CoV-2 [6, 8] (hình 2).
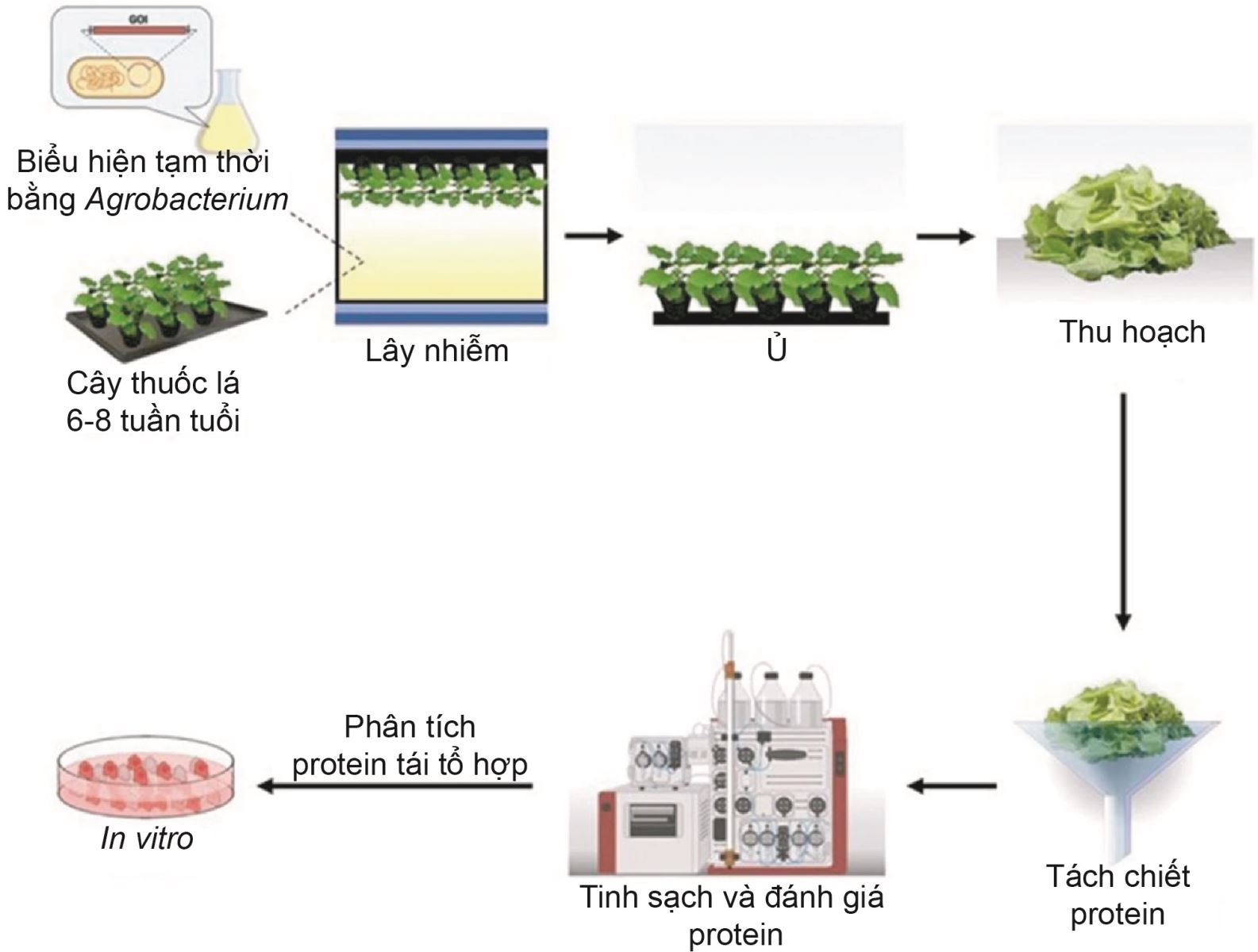
Hình 2. Quy trình tạo ra RBD của SARS-CoV-2 và mAb CR3022 từ cây thuốc lá.
Sử dụng thực vật trong sản xuất vaccine COVID-19
Phương thức sản xuất vaccine từ tế bào động vật truyền thống thường dựa trên các chủng SARS-CoV-2 đã bị bất hoạt hoặc làm giảm độc lực mất nhiều thời gian, đôi khi cũng xảy ra nguy cơ virus tái độc lực. Một phương pháp thay thế nhanh và an toàn hơn là sản xuất vaccine tiểu đơn vị (vaccine chỉ chứa một phần mang tính kháng nguyên của SARS-CoV-2) hoặc dưới dạng VLP. Cả hai phương pháp này đều đang được phát triển thành công cụ để chống đại dịch COVID-19.
Tất cả 4 protein cấu trúc của virus SARS-CoV-2 đều có thể gây ra trong cơ thể những kháng thể trung hòa (neutralizing antibody) và đáp ứng của tế bào lympho T-CD4+/CD8+, từ đó đảm bảo miễn dịch đặc hiệu chống lại virus.
Tuy nhiên, do cấu trúc vỏ bọc nhân của họ coronavirus (bao gồm các loại virus cúm mùa thông thường) có tính tương đồng và bảo thủ cao, các kháng thể kháng lại protein N của SARS-CoV-2 không tạo ra khả năng miễn dịch đặc hiệu bảo vệ cơ thể. Trong khi đó, cấu trúc gai S của virus SARS-CoV-2, đặc biệt là tiểu đơn vị S1 (SARS-CoV-like_Spike_S1_RBD, mã định danh vùng bảo thủ: cd21480) có kích thước 685 aa, có thể liên kết với enzym chuyển hóa angiotensin 2, thụ thể chủ trên bề mặt tế bào người, từ đó giúp virus SARS-CoV-2 có thể xâm nhập. Do đó, hầu hết các sản phẩm tiềm năng làm vaccine COVID-19 đều hướng đến protein gai S.
Đến nay, nhiều sản phẩm vaccine tiểu đơn vị đã được tổng hợp trên tế bào thực vật, bao gồm một số chủng virus cúm mùa hoặc cúm dịch tạo ra bằng cách biểu hiện tạm thời trên cây thuốc lá. Các loại vaccine này có thể được sản xuất trong vòng 3-6 tuần kể từ khi giải mã được trình tự của hai kháng nguyên đặc trưng của virus cúm (hemagglutinin và neuraminidase).
Với kỹ thuật biểu hiện tạm thời sử dụng A. tumefaciens mang vector dựa trên virus khảm thuốc lá trên cây thuốc lá, khoảng 200 mg protein mục tiêu có thể được tạo ra từ mỗi kg lá tươi. Mới đây, Công ty Kentucky BioProcessing (Hoa Kỳ) đang phát triển vaccine chống COVID-19 dựa trên kháng nguyên RBD bằng cách tạo ra hệ thống biểu hiện tạm thời mang tiểu đơn vị S1 trên cây thuốc lá [6, 9].
Sản phẩm vaccine này đã kết thúc thử nghiệm tiền lâm sàng trên động vật vào tháng 4/2020 và đang được thử nghiệm lâm sàng giai đoạn 1-2 trên 180 người tình nguyện khỏe mạnh có độ tuổi 18-70 tại Mỹ.
Việc tạo ra kháng nguyên SARS-CoV-2 dạng VLP giúp vaccine có nhiều ưu điểm vì các hạt này chứa nhiều bản sao của kháng nguyên, có thể kích thích mạnh mẽ các tế bào miễn dịch (lympho B và T) thông qua cơ chế trình diện kháng nguyên, tăng hiệu quả của phản ứng miễn dịch.
Hơn nữa, VLP có nguồn gốc từ virus thực vật không thể nhân lên trong cơ thể người, do đó đảm bảo tính an toàn. Mới đây, Công ty Medicago (Canada) đã phát triển vaccine SARS-CoV-2 dựa trên VLP có nguồn gốc từ cây thuốc lá, sản phẩm này đã kết thúc thử nghiệm lâm sàng giai đoạn 1 và bắt đầu đánh giá giai đoạn 2 vào tháng 10/2020 [10].
Tương tự, iBio (Hoa Kỳ) đang phát triển vaccine dựa trên VLP chống COVID-19, tên thương mại là IBIO-200 và IBIO-201, trên cây thuốc lá dựa trên hệ thống FastPharming độc quyền [6, 10].
Một chiến lược khác trong điều trị COVID-19 là sử dụng huyết thanh của bệnh nhân đã bình phục để làm giảm mức độ nghiêm trọng của các triệu chứng bệnh, đặc biệt là hội chứng giải phóng cytokine, xảy ra do tình trạng hệ miễn dịch của cơ thể phản ứng quá mức với sự xâm nhập của SARS-CoV-2 và dẫn đến phản ứng viêm toàn hệ thống.
Thực vật cũng có thể được sử dụng để tổng hợp ra hai kháng thể đơn dòng, sarilumab (có trong thuốc Kevzara) và tocilizumab (có trong thuốc Actemra), phục vụ điều trị trên bệnh nhân nhiễm COVID-19 nặng [6].
Sử dụng thực vật trong sản xuất thuốc chống virus SARS-CoV-2
Thuốc chống virus ngăn chặn chu trình nhân lên của virus, nhờ đó làm chậm sự lây nhiễm và tạo điều kiện cho hệ miễn dịch thêm thời gian đáp ứng. Trong đó, protein, đặc biệt là lectin (protein liên kết với carbonhydrate) từ thực vật có thể được sử dụng làm thuốc chống virus. Ví dụ, griffithsin được biết đến là một phân tử lectin phân lập từ một loài tảo đỏ của chi Griffithsia, có hoạt động như một chất ức chế chống lại nhiều loại virus như HIV, Ebola Zaire, SARS-CoV và MERS-CoV [11].
Tương tự, scytovirin là một lectin phân lập từ vi khuẩn lam Scytonema varium, cũng có khả năng chống lại nhiều loại virus, bao gồm HIV, Ebola Zaire, Marburg và SARS-CoV [6].
Đến nay, khoảng 20 loại lectin thực vật khác nhau đã được ghi nhận có khả năng chống lại được SARS-CoV thông qua con đường ức chế sự gắn kết của các thụ thể trên tế bào biểu mô đường hô hấp với kháng nguyên hemagglutinin của virus [6].
Tuy nhiên, những loại lectin này có thể vô hiệu hóa được SARS-CoV-2 hay không vẫn là một câu hỏi, nhưng như đã biết, các gai S nhô lên trên bề mặt của SARS-CoV và SARS-CoV-2 có mức độ bảo thủ và độ tương đồng cao [7], vì vậy phản ứng chéo hoàn toàn có thể xảy ra [6].
Hiện nay, các nhà khoa học đã chứng minh rằng lectin liên kết với mannose lectin đặc hiệu với galactose, N-acetylgalactosamine, glucose và N-acetylglucosamine thể hiện hoạt tính chống lại SARS-CoV mạnh thông qua cơ chế tấn công vào chu trình nhân lên của virus [11, 12]. Một số loại cây trồng đã được sử dụng để sản xuất hàng loạt các lectin chống virus, bao gồm các griffithsin, cyanovirin-N và protein dung hợp cyanovirin-N, trong thời gian ngắn, thông qua phương pháp biểu hiện tạm thời [6].
Thay lời kết
Đại dịch COVID-19 đã tạo ra nhu cầu khổng lồ về thuốc thử chẩn đoán SARS-CoV-2, đặt gánh nặng lớn lên chuỗi cung cấp và phân phối toàn cầu. Biểu hiện tạm thời trên thực vật có thể giải quyết sự thiếu hụt này nhờ khả năng sản xuất nhanh chóng trên quy mô lớn với chi phí tối thiểu dựa trên việc tạo ra số lượng lớn các cây chuyển gen.
Công nghệ sử dụng để sản xuất thuốc thử chẩn đoán cũng có thể được dùng để sản xuất sản phẩm có tiềm năng làm vaccine hay các kháng thể trị liệu và protein kháng virus. Tuy nhiên, những lợi thế này chưa đủ thuyết phục để thay thế các nền tảng truyền thống vốn có trong ngành công nghiệp sản xuất dược phẩm sinh học.
Nguyên nhân là do các nền tảng lâu đời này sử dụng vi khuẩn E. coli và một số vi sinh vật khác, cùng nhiều dòng tế bào động vật có vú khác nhau, phần lớn các hệ thống sinh vật này đã có khuôn khổ pháp lý chặt chẽ, cùng với sự đầu tư lâu dài vào các công nghệ sản xuất tương ứng. Dù vâỵ, trong một số trường hợp nhỏ, thực vật lại trở nên nổi bật vì chúng có thể tạo ra các dược phẩm sinh học có cấu trúc glycan có lợi (ví dụ như taliglucerase alfa) và cho phép sản xuất trên quy mô lớn (ví dụ như thuốc điều trị HIV).
Tại Việt Nam, việc tiếp cận công nghệ sản xuất vaccine sử dụng axit nucleic còn hạn chế. Do vậy, công nghệ biểu hiện tạm thời trên thực vật có thể đem lại nhiều tiềm năng trong phát triển các loại chất thử phát hiện, vaccine và thuốc kháng COVID-19, tương tự như những thành công của nước ta trước đây trong sản xuất vaccine đường ăn cho gia súc. Trong tương lai, thế giới sẽ tiếp tục phải đối mặt với nhiều đại dịch khác, vì vậy, hoàn thiện và làm chủ được những công nghệ sản xuất thuốc thử phát hiện, vaccine và thuốc điều trị bệnh là rất cần thiết.
TÀI LIỆU THAM KHẢO
[1] M.A. D'Aoust, et al. (2010), "The production of hemagglutinin-based virus-like particles in plants: a rapid, efficient and safe response to pandemic influenza", Plant Biotechnol. J., 8, pp.607-619.
[2] R. Fischer, J.F. Buyel (2020), "Molecular farming - the slope of enlightenment", Biotechnol Adv., 40, DOI: 10.1016/j.biotechadv.2020.107519.
[3] D. Tuse, et al. (2020), "The emergency response capacity of plant-based biopharmaceutical manufacturing - what it is and what it could be", Front Plant Sci., 11, DOI: 10.3389/fpls.2020.594019.
[4] M. Riccò, et al. (2020), "Point-of-care diagnostic tests for detecting SARS-CoV-2 antibodies: a systematic review and meta-analysis of real-world data", J. Clin. Med., 9(5), p.1515.
[5] S.K. Chan, et al. (2020), "Biomimetic virus-like particles as SARS-CoV-2 positive controls for RT-PCR diagnostics", ACS Nano, DOI: 10.1021/acsnano.0c08430.
[6] T. Capell, et al. (2020), "Potential applications of plant biotechnology against SARS-CoV-2", Trends Plant Sci., 25, pp.635-643.
[7] Y. Huang, et al. (2020), "Structural and functional properties of SARS-CoV-2 spike protein: potential antivirus drug development for COVID-19", Acta. Pharmacologica Sinica., 41, pp.1141-1149.
[8] K. Rattanapisit, et al. (2020), "Rapid production of SARS-CoV-2 receptor binding domain (RBD) and spike specific monoclonal antibody CR3022 in Nicotiana benthamiana", Sci. Rep., 10, pp.17698.
[9] S. Rosales Mendoza (2020), "Will plant-made biopharmaceuticals play a role in the fight against COVID-19?", Expert Opin. Biol. Ther., 20, pp.545-548.
[10] S.P. Kaur, V. Gupta (2020), "COVID-19 vaccine: a comprehensive status report", Virus Res., 288, pp.198114.
[11] Y. Cai, et al. (2020), "Griffithsin with a broad-spectrum antiviral activity by binding glycans in viral glycoprotein exhibits strong synergistic effect in combination with a pan-coronavirus fusion inhibitor targeting SARS-CoV-2 spike S2 subunit", Virologica Sinica, 1-4, DOI: 10.1007/s12250-020-00305-3.
[12] A.S. Świerzko, M. Cedzyński (2020), "The influence of the lectin pathway of complement activation on infections of the respiratory system", Front. Immunol., 11, pp.585243.
Chu Đức Hà1, Phạm Công Tuyên Ánh1, 2, Lê Thị Ngọc Quỳnh3,
Phạm Phương Thu4, Nguyễn Quốc Trung2, Nguyễn Hữu Đức2, Phạm Xuân Hội1
1Viện Di truyền Nông nghiệp, Viện Khoa học Nông nghiệp Việt Nam
2Khoa Công nghệ sinh học, Học viện Nông nghiệp Việt Nam
3Bộ môn Công nghệ sinh học, Trường Đại học Thủy lợi
4Khoa Sinh - Kỹ thuật nông nghiệp, Trường Đại học Sư phạm Hà Nội 2
Nguồn: Tạp chí Khoa học công nghệ Việt Nam


Hiệu ứng nhà kính và các giải pháp từ tiêu chuẩn

Sắp diễn ra hội thảo “Chất lượng nước - Những kỹ thuật mới nhất trong kiểm soát và đánh giá chất lượng”

Chỉ số đánh giá và hỗ trợ doanh nghiệp chuyển đổi số

TCVN 13751:2023 - Tiêu chuẩn quốc gia đối với chuyên gia năng suất

Triển lãm Dụng cụ Khoa học lần thứ 35 (JASIS 2023) có gì mới?

Nghiên cứu ứng dụng tài nguyên thực vật Việt Nam trong công nghệ môi trường và dược mỹ phẩm

Một số điểm mới của ISO/IEC 17043:2023

Lấy ý kiến hoàn thiện hồ sơ Đề nghị xây dựng Luật sửa đổi, bổ sung một số điều của Luật CLSPHH
Mô hình AI chuyển hóa hình ảnh chụp X-quang thành công cụ chẩn đoán tim mạch

Xu hướng công nghệ trong năm 2023 và các năm tiếp theo













