
Protein tổng hợp phối hợp phát tín hiệu gây ung thư để điều trị ung thư
TNNN - Một trong những thách thức lớn trong nghiên cứu bệnh ung thư là phát triển các chiến lược xác định và nhắm tới tiêu diệt các tế bào ác tính, đồng thời không gây hư hại các tế bào khỏe mạnh.
Tế bào ung thư có một số đặc điểm riêng biệt giúp phân biệt chúng với các tế bào khỏe mạnh, có thể sử dụng làm mục tiêu điều trị. Ví dụ, các thụ thể xuyên màng tế bào thường bị đột biến hoặc biểu hiện quá mức trong tế bào ung thư, dẫn đến kích hoạt cấu thành các đường dẫn tín hiệu để cung cấp các tín hiệu tăng trưởng liên tục. Thiết kế các protein tổng hợp để xác định cách hoạt động quá mức này và tiêu diệt tế bào ung thư mà không gây hại cho các tế bào khỏe mạnh, đồng thời chứng minh tiềm năng của sinh học tổng hợp để tạo ra các giải pháp mới cho những thách thức trong y học.
Tua lại có lợi cho chúng ta
Sinh học tổng hợp là kỹ thuật sinh học, liên quan đến tổng hợp các hệ thống phức tạp dựa trên cơ sở sinh học có các chức năng không tồn tại trong tự nhiên. Ứng dụng sinh học tổng hợp để vượt qua những thách thức trong sản xuất, nông nghiệp và thậm chí cả y học.
Tại phòng thí nghiệm của Trường Y thuộc Đại học Stanford, Tiến sĩ Michael Lin và các đồng nghiệp của ông đang phát triển các cách thiết kế protein để thực hiện các chức năng cảm biến hoặc kiểm soát tùy chỉnh. Theo Lin, nghiên cứu này phục vụ “để tạo ra các công cụ cho các nhà sinh vật học khác sử dụng và phát triển các phương pháp điều trị mới cho các bệnh phức tạp” — Ung thư là một căn bệnh cực kỳ phức tạp.
Một số thụ thể xuyên màng tế bào nhất định được kích hoạt thoáng qua trong các tế bào khỏe mạnh, cụ thể là các tyrosine kinase thụ thể họ ErbB bao gồm ErbB1 và ErbB2, có thể bị kích hoạt cấu thành trong tế bào ung thư, thúc đẩy sự phát triển và tăng sinh bất thường. Người ta đã thiết kế các phương pháp điều trị khác nhau để nhắm đích vào các thụ thể này, nhưng có tác dụng hoàn toàn hoặc không ảnh hưởng đến việc chúng ức chế tất cả các thụ thể hoặc loại bỏ các tế bào có biểu hiện khác thường, tạo ra thách thức với độc tính.
Lin và các đồng nghiệp của ông đã phát triển một hệ thống tổng hợp gọi là RASER (Rewiring of Aberrant Signaling to Effector Release – Tua lại tín hiệu Aberrant để giải phóng hiệu ứng) nhắm các tế bào ung thư dựa trên các tầng tín hiệu qua trung gian thụ thể xuyên màng. Hệ thống này dựa trên thiết kế các protein tổng hợp để thông qua đó tìm hiểu trạng thái của con đường tín hiệu liên quan đến các thụ thể xuyên màng tế bào này và thực hiện phác đồ điều trị nếu phát hiện trạng thái gây ung thư. Bằng cách này, hệ thống tua lại tín hiệu gây ung thư để vận chuyển “vật chất” đến các tế bào ung thư. Vật chất này là một protein hiệu ứng, Lin giải thích: “khi được giải phóng, [nó] có thể là thứ giết chết tế bào hoặc kích hoạt chương trình phiên mã”.
Các cặp protein tổng hợp có các chức năng khác nhau. Ông nói: “Một protein chứa một protease virus, protein còn lại là chất nền cho protease đó và một vùng hiệu ứng có thể lập trình được. "Hai protein tập hợp tại một protein đột biến gây ung thư kích hoạt để giải phóng hiệu ứng tương ứng với tổng tín hiệu tích hợp." Vì protein thụ thể luôn “bật”, lượng vật chất đủ dự trữ và phát huy tác dụng của nó trên tế bào.
Cách tiếp cận tổng hợp này mang lại một số lợi thế so với các phương pháp điều trị hiện có. Trước hết, có khả năng lập trình cao và có thể được thiết kế để cảm nhận các protein đột biến gây ung thư khác nhau và để kích hoạt các hiệu ứng khác nhau. Hơn nữa, nó không thể trốn tránh thông qua sự biến đổi protein đột biến gây ung thư. Lin giải thích: “Chúng tôi sử dụng các miền liên kết từ các tác nhân tự nhiên của protein đột biến gây ung thư. “Điều này có nghĩa là protein đột biến gây ung thư không thể biến đổi xung quanh sự nhận dạng của RASER mà không làm mất khả năng kích hoạt hoặc tăng sinh của tế bào”. Về cơ bản, nếu protein đột biến gây ung thư biến đổi và trốn tránh RASER, nó sẽ không còn chức năng thúc đẩy sự phát triển của tế bào ung thư.
Kết hợp hóa sinh và mô hình toán học
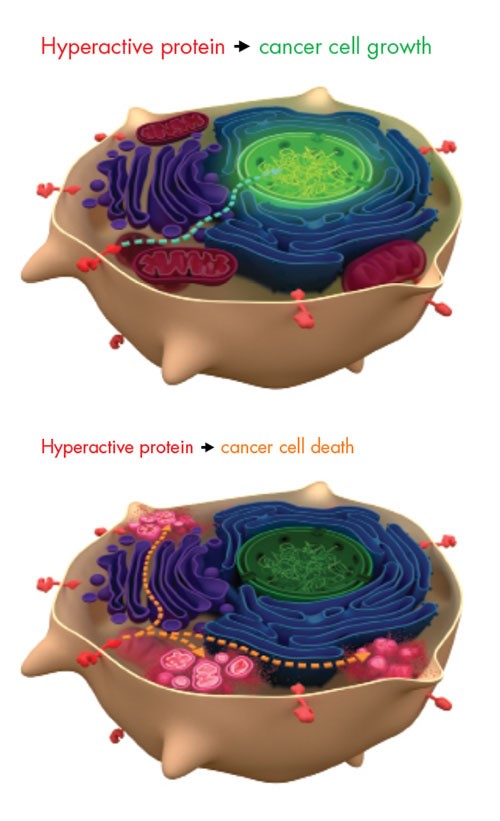
Hình trên: Protein hoạt động mạnh - Tế bào ung thư tăng trưởng;
Hình dưới: Protein hoạt động mạnh -Tế bào ung thư chết
Xác định và hiểu các tương tác protein là điểm khởi đầu quan trọng trong sự phát triển của RASER. May mắn thay, số lượng các tương tác protein-protein đã biết vẫn tiếp tục tăng và có rất nhiều cơ sở dữ liệu công khai chứa dữ liệu định lượng. Lin giải thích: “Vì vậy, chủ yếu cung cấp kiến thức này cho chúng tôi, mặc dù chúng tôi phải thực hiện các phép đo của riêng mình đối với một số thông số như chu kỳ bán rã của protein. Tổng hợp lại, thông tin này cho biết việc lựa chọn các thành phần mà nhóm muốn sử dụng.
Lý tưởng nhất là trong các tế bào có các thụ thể xuyên màng hoạt động mạnh, thành phần protease của các protein tổng hợp sẽ được đưa vào màng nơi nó sẽ phân cắt chất nền và giải phóng vật chất. Đầu tiên, nhóm nghiên cứu đã sử dụng một mô hình toán học để xác định phạm vi hoạt động có thể có của hệ thống. Lin nói: “Khi các mô hình tạo ra dải động có thể sử dụng được, chúng tôi biết rằng mình đã đi đúng hướng.
Ông giải thích: “Sau đó, chúng tôi tạo ra một loạt các protein RASER và thử nghiệm chúng một cách nghiêm ngặt trong các dòng tế bào ung thư và không ung thư. Các dòng tế bào được điều trị bằng vi-rút đậu lăng biểu hiện ErbB-RASER1C-Bid, hoặc sử dụng các loại thuốc làm tiêu chuẩn đầu tiên trong chăm sóc ung thư vú và ung thư phổi di căn (hóa trị liệu kết hợp carboplatin, paclitaxel và lapatinib). Trong khi điều trị hóa trị kết hợp tiêu diệt cả tế bào ung thư, tế bào khỏe mạnh và độc tính tế bào lapatinib khác nhau, RASER tiêu diệt tỷ lệ lớn tế bào ung thư đồng thời ảnh hưởng không đáng kể đến các tế bào khỏe mạnh. Độ đặc hiệu cao như vậy hứa hẹn vượt qua những thách thức về độc tính trong quá trình phát triển các phương pháp điều trị ung thư mới.
Theo Lin, quá trình phát triển RASER “đòi hỏi sự kết hợp của kiến thức hóa sinh sâu rộng, một số mô hình toán học và thử nghiệm có hệ thống”. Mặc dù quá trình này rất phức tạp và liên quan đến nhiều quản trị thông tin, Lin lưu ý rằng các RASER trong tương lai có thể phát triển hạng mục này, “vì vậy nó sẽ dễ dàng thực hiện hơn”.
Lin giải thích: “Thách thức lớn nhất là các công cụ của chúng tôi để protein biểu hiện nhanh chóng. Ông và các đồng nghiệp của mình nhận thấy rằng các ca nhiễm trùng thoáng qua quá biến đổi và dẫn đến biểu hiện quá mức. Đây là một nhược điểm chung của hiện tượng chuyển nhiễm nhất thời, trong đó đưa vào các axit nucleic chỉ tồn tại trong tế bào một thời gian ngắn, nhưng tạo ra số lượng lớn bản sao của vật liệu di truyền vận chuyển và biểu hiện protein cao. Kết quả là, Lin nói: “chúng tôi đã kết thúc việc tạo ra các cấu trúc lentivirus để thực hiện hầu hết các kết quả đã được công bố của chúng tôi”. Không giống như hiện tượng chuyển nạp nhất thời, truyền gen tích hợp ADN của virus vào ADN của vật chủ và được truyền cho các thế hệ tiếp nối trong quá trình phân chia tế bào.
Thử thách tiếp theo đối với RASER sẽ là việc đưa nó vào một số lượng lớn các tế bào khối u và xác định “Cho phép nó truyền qua các khối u ra sao” Lin nói. Ông giải thích: “Chúng tôi đang tạo ra các RASER virut bằng cách bắt đầu đơn giản, nhưng chúng tôi hy vọng trong tương lai sẽ kết hợp các phương pháp tạo ra các loại virut cụ thể phù hợp hơn để tấn công tế bào ung thư.
Nhiều lựa chọn về sinh học tổng hợp trong điều trị ung thư
RASER không phải là phương pháp sinh học tổng hợp duy nhất được sử dụng để điều trị ung thư. Liệu pháp tế bào T mang thụ thể kháng nguyên dạng khảm (CAR T-cell) là một liệu pháp miễn dịch tế bào T được áp dụng trong đó biến đổi gen các tế bào T của bệnh nhân để tạo ra các thụ thể kháng nguyên dạng khảm (CAR), cho phép nhận ra các kháng nguyên này trên tế bào khối u. Có một số liệu pháp tế bào T CAR đã được FDA chấp thuận cho các dạng bệnh bạch cầu và ung thư hạch cụ thể.
Trong khi đầy hứa hẹn, những thách thức vẫn còn đối với các liệu pháp tế bào T mang thụ thể kháng nguyên dạng khảm. Ví dụ: “Tế bào CAR-T vẫn gặp khó khăn khi xâm nhập vào các khối u rắn”, Lin nói thêm: “virus RASER có thể là một chất chống ung thư có mục tiêu duy nhất là có thể tìm đường đến các khối u ở bất cứ đâu trong cơ thể”. Liệu RASER có hiệu quả trong các khối u ở người hay không vẫn còn đang được nghiên cứu. Tuy nhiên, khả năng tùy biến và hoạt động có mục tiêu cao khiến liệu pháp này trở thành một chiến lược vô cùng hấp dẫn để phát triển hơn nữa trong tương lai.
Tiến sĩ Michelle Dotzert
Tố Quyên dịch
Nguồn: Lab Manager- Hoa Kỳ


Cấp thiết sửa đổi quy chuẩn kỹ thuật quốc gia cho sản phẩm sữa chế biến

Kiểm tra, xác nhận giá trị sử dụng phương pháp; ước lượng độ không đảm bảo đo lĩnh vực sinh học

Đảm bảo chất lượng kết quả thử nghiệm

Nhận thức chung ISO/IEC 17025:2017 và đánh giá nội bộ

Xác nhận giá trị sử dụng phương pháp thử trong phân tích hóa học

Triệt để tránh tình trạng “dễ làm, khó bỏ” trong nghiên cứu khoa học

Báo động: Vi nhựa xâm nhập não người với tốc độ nhanh

Hiệu ứng nhà kính và các giải pháp từ tiêu chuẩn

Sắp diễn ra hội thảo “Chất lượng nước - Những kỹ thuật mới nhất trong kiểm soát và đánh giá chất lượng”

Chỉ số đánh giá và hỗ trợ doanh nghiệp chuyển đổi số













